2016 年1 月11 日,美国专利与商标局宣布启动抵触审查程序(Interference proceeding), 重新审核CRISPR/Cas9 技术的专利。
三天后的1 月14 日,《Cell》杂志一篇关于CRISPR 的综述,让美国科学界对麻省理工学院 博德研究所的Eric Lander 群起而攻之。谁发明了CRISPR?谁的功劳最大?人们争论不休。
一些科学家甚至调侃道:“CRISPR 的功劳应该归谁?真相是,应该归细菌——它们首先发明了CRISPR。”
可是,CRISPR 到底怎么来的?浙江大学生命科学研究院教授王立铭就此写了三篇关于基因 编辑技术的综述文章,尤其重点呈现了CRISPR 的产生历史。《知识分子》经授权刊发其精 选内容。
《知识分子》与作者王立铭特别声明:不存在与CRISPR 相关的任何利益冲突。 文| 王立铭(浙江大学生命科学研究院教授)
●●●
CRISPR 的发音和一个英文单词“ crisper ” (冷藏保鲜盒,就是冰箱里面专门放瓜果蔬 菜的那个透明抽拉盒)一样,发音清脆,鲜活水灵。而提及它的全称——“ 成簇规律间隔 短回文重复序列” (Clustered Regularly Interspaced Short Palindromic Repeats), 让人不明觉厉。正是这个后来者,一个猛子扎到基因组编辑的领地里,甚至成功地扮演了整 个基因治疗领域搅局者的角色。
要说起CRISPR 技术的由来,甚至比锌手指蛋白和TALEN 蛋白(编者注:在发现CRISPR 之前 两项重要的基因编辑技术)还要更天外飞仙一点。
用于基因组定位的锌手指蛋白和TALEN 蛋白虽然来源和机理并不相同,但是它们工作的逻辑 却是很接近的。两者本身的生物学功能,都是定位基因组上的特定基因序列。
锌手指蛋白最早发现于非洲爪蟾的细胞,它们被用来定位基因组序列并启动特定基因的转录 和蛋白质合成;而TALEN 蛋白来自一类特殊的植物细菌——黄单胞菌,其功能也是被用来定 位基因组序列——只不过这回是被细菌用来偷梁换柱启动它所寄居的植物细胞的基因转录。
对于几乎所有的有机生命来说,利用某种工具来精细调节遗传信息的“利用度”,决定在何 时、何地、哪种场合下开启或关闭哪些基因,都是对生存繁衍至关重要的能力。
因此,毫不奇怪大自然亿万年的进化产生了像锌手指蛋白和TALEN 蛋白这样具备高超的基因 组定位能力的物质。同样,这大自然的馈赠被万物之灵的人类加以利用,用于精确修正人类 自身的遗传信息,不管经历了多少曲折和反复,终究也是合乎逻辑的事情,是不是?
但是CRISPR 的缘起可就与此毫不搭界了。这个新鲜的小家伙当然同样是亿万年进化的产物, 不过它原本的功能可不是用来精密调节基因组的开关,而是——细菌的免疫系统。
什么?细菌也有免疫系统?话说我们人类的免疫系统不就是用来对付这些讨厌的小虫子的 么?怎么这些小虫子自己也有所谓的免疫系统?
你没听错。本身就是高等生物免疫系统绞杀对象的细菌,自身也有需要对付的寄生生物—— 病毒。而这类专门欺负细菌的病毒,我们管它们叫噬菌体(bacteriophage,或者简称phage)。
要说这背后的逻辑并不奇怪。病毒作为地球上最简单的有机生命形式,没有独立生存繁衍的 能力,它们必须选择一种更复杂的有机生命作为宿主,通过入侵宿主细胞、利用宿主细胞的 资源复制自身再开枝散叶,才能够完成生命繁衍的循环。
在漫长的进化史上,有些病毒选择了入侵动物(比如乙肝病毒),有的选择了入侵植物(比 如烟草花叶病毒,这是世界上第一种被发现的病毒),而有的选择了入侵细菌。别看细菌个 头小,它们还是要比病毒大上数百倍,足够噬菌体们藏身和繁殖了,而且我们的地球上细菌 的数量可能是所有“高等”生命的亿万倍,光一个人口腔里的细菌数目就超过全世界的人口 总数,因此噬菌体们也不愁找不到可以安身立命的寄居地。
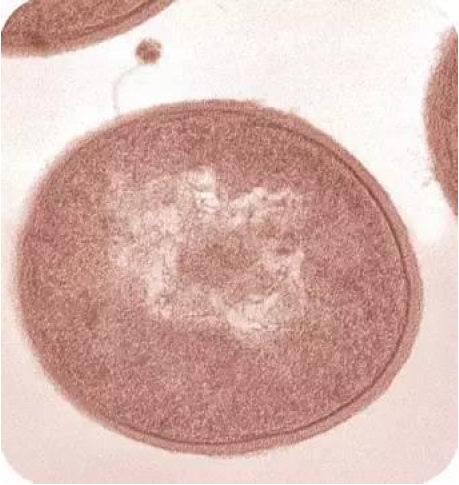
在电子显微镜下,可以清晰的看到一个噬菌体病毒(上方的带着细细”针头“的小颗粒)正 在入侵一个细菌(图片来自Marx,Science 2007)。
而对于被青睐的细菌而言,噬菌体们可就是不折不扣的麻烦制造者了,就像我们人类讨厌各 种各样给我们带来疾病的细菌一样。没有办法像高等生物一样专门开发出一套免疫系统来对 付入侵者,小小的细菌也有自己的不二法门。
这个法门就是CRISPR。
从CRISPR 的全名“ 成簇规律间隔短回文重复序列”,大家也可以大致猜测出,CRISPR 本 身其实就是基因组DNA 上的一段特殊的序列,这段序列倒是很有个性:几十个碱基构成的特 殊DNA 序列连续串联重复多次,在重复单元之间的间隔也差不多有几十个碱基那么长,但是 这些间隔序列的构成却是千变万化毫无规律可循。
当上个世纪八十年代末,日本科学家在几种细菌的基因组上发现这么一长串很有个性的序列 时也着实被迷惑了,只好老老实实地在论文里描述了一下它的样子就束之高阁了。这一迷惑, 居然就过了差不多二十年。在此期间世界各地的科学家陆续在不同的细菌中发现了类似的 CRISPR 序列,但是始终不清楚这种序列到底意味着什么。
这张卡通图描述了一段典型的CRISPR 序列的模样。用数字标记的浅蓝色线段代表了串联重 复的DNA 序列,而深蓝色的线段则是千变万化的非重复序列。在之后的研究中,科学家们逐 渐发现许许多多细菌中都有类似结构的CRISPR 序列。(图片来自Makarova et al,Nature Rev. Microbiol. 2011)
直到二十世纪初,随着大规模基因组测序技术的成熟和生物信息学的兴起,人们逐渐积累了 大量细菌物种的完整的、从头到尾的基因组DNA 序列信息。这时候科学家们已经可以不必费 心费力在实验室一种一种细菌去筛查基因组DNA 序列,只需要在电脑前写几行程序代码,就 可以分析成百上千种不同细菌中是否存在相似的序列了。于是这时候又有记性比较好的科学 家,回头想起了这种困惑大家二十年的、很有性格的序列。
不比不知道,一比吓一跳。在2000 年就有几位这样记性很好的西班牙科学家查看了下当时 已经具有完整基因组信息的许多种细菌,居然看到二十来种细菌和古细菌(古细菌是一种相 比细菌更加原始的单细胞生物)里,都带有结构组成相当类似的CRISPR 序列!
这就有意思了,要知道对于任何有机生命来说,小心翼翼地保存、复制和传递遗传物质信息 都是件很困难、也很浪费资源的事情。在自然选择的作用下,很难想象会有这么多不同的物 种会不约而同的保留这么长长一串一点功能也没有的DNA 序列。因此,一个直觉的猜测就是, CRISPR 序列应该是有生物学功能的,而且很可能是对细菌来说至关重要的功能。
于是这帮好记性的西班牙科学家再接再厉。到2005 年,他们继续搜集了六十多种细菌中多 达4500 段CRISPR 序列(严格来说,是CRISPR 中花样较多的“间隔”序列的信息),发现 其中有88 段居然在不同物种中重复出现。更妙的是,这其中还有相当部分(47 个)的序列,恰好还和许多当时已知的噬菌体基因组序列信息高度一致!打个不那么恰当的比方,就像细 菌深处,不知道为什么偷偷隐藏了不少噬菌体病毒的高清自拍照!
这太好玩了,细菌对噬菌体避之唯恐不及,怎么可能还小心翼翼收藏它们的自拍?
生物学家们一般情况下不会有这种过度浪漫的情怀。他们的第一反应很简单:既然细菌讨厌 噬菌体,却又费心费力的在基因组里留下各种噬菌体的序列信息,那么大概应该也许可能是 用来对付噬菌体入侵的武器吧!这个逻辑也很容易验证:如果真的是这样,那么拥有噬菌体 自拍的细菌应该不容易被病毒入侵,反而那些没有噬菌体自拍的细菌就成了病毒理想的栖息 地。这个假设很快在计算机上被验证。
而很快在2007 年,一群在杜邦公司旗下的丹尼斯克食品配料公司工作的科学家,在嗜热链 球菌中,严格证明了CRISPR 序列对于细菌免疫系统的功能:他们证明,在这种细菌中人工 添加一段CRISPR 序列,就可以像给细菌打了疫苗一样,可以帮助细菌抵挡某种对应病毒的 入侵!这群科学家同时也证明,细菌的免疫系统还有自我进化的高级功能,每当有新的噬菌 体病毒入侵,细菌就可以把它的基因组序列整合到自己的CRISPR 序列中,这样下次同样的 病毒入侵细菌就可以正确识别和对抗它们了。
嗜热链球菌(Streptococcus thermophulus),现代酸奶工业的基石之一。而这种细菌的存 活受到多种噬菌体入侵的威胁。笔者不揣冒昧地想象,也许正是为了解决由于噬菌体入侵导 致的酸奶生产问题,丹尼斯克(Danisco)的科学家们证明了CRISPR 的免疫力。(图片来自 www.emaze.com)
好了,这个发现应该足够惊悚了。原来以为只有像人类这样的高等生物才有的免疫系统,原 来只有一个细胞、几十微米大小的细菌居然也有,而且还居然具备自我进化、迅速适应和对 抗新病毒入侵的能力。从任何角度出发,这都是项足以载入史册的重大发现。这个发现自身 就无比优雅和简练地说明了有机生命的伟大生命力。
小小的细菌,没有多余的空间和资源来负担复杂的免疫系统对抗入侵者,仅仅用自身基因组 序列上的一小段重复DNA 片段,就能够抵挡病毒的侵袭。这种能力应该让至今仍被流感病毒 所困的人类自愧不如吧!
大家可能要问了,这个发现确实很有趣、很重要,但是你怎么讲着讲着基因组编辑和基因治 疗,突然开始扯细菌的免疫系统了?
别急别急。讲完了CRISPR 的由来,我却有意略过了CRISPR 对抗病毒的机制。读者们不妨关 上手机屏幕想上几分钟:一段不会跑也不会跳的DNA 序列,怎么能识别并抵挡病毒入侵呢? CRISPR 的这种神奇的能力,很快被发现和了解。而也正是这种能力,构成了一种热热闹闹 的基因组编辑技术的基石。
超轻量级基因组GPS
其实发现细菌CRISPR 序列和噬菌体基因组序列高度一致之后,科学家们在第一时间就很敏 锐地意识到,也许CRISPR 序列的目的正是定位入侵的病毒。注意这里的关键词:定位!
我们知道,病毒颗粒是不具备独立完成生命生存繁衍整个循环的能力的。病毒的“生命力” 本身,就依赖于病毒颗粒首先进入宿主细胞中,释放出自身的遗传物质,并且利用宿主细胞 的资源帮助其复制扩增其遗传物质。
换句话说,病毒进入细胞的第一件事就是迫不及待地把自己的遗传物质给暴露出来,这是它 生存繁衍的第一要务。而细菌是不是也可以利用这一点来实现对病毒的精确打击?比如说, 细菌基因组上的CRISPR 序列,是不是就是为了提供一个互补的“地图”,让细菌知道什么 时候有病毒基因组进入细胞了?
这个可能性迅速得到了验证。科学家们发现,细菌的CRISPR 序列在正常情况下是可以被转 录成RNA 分子、游离于细胞当中的。这些小段CRISPR RNA 分子能够充当向导的角色,带着 一个蛋白复合体,在细胞体内终日游荡。而当某时某地某个情况,病毒入侵、病毒DNA 充斥 细胞时,这个蛋白复合体就有用武之地了。一旦它发现某个病毒DNA 的序列,和自身向导的 序列完全一致,它就可以大发神威,把病毒DNA 咔嚓一刀断了根。一刀两断的病毒当然就失 去了鼠窃狗偷、继续利用细菌的资源生存繁衍的能力了。
我们一句话总结就是,细菌的免疫系统其实就两个几段简化的组件,CRISPR RNA 的功能类 似于锌手指蛋白和TALEN 蛋白,用来精确定位病毒的入侵;而这个蛋白复合体的功能则类似 于FokI 核酸酶,专门剪断已经被识别的病毒。
小小细菌的本事当真让人叹为观止。要知道为了实现对基因组序列的精确识别,高等生物进 化出了花样繁多、结构复杂的锌手指蛋白。其中,很天然锌手指蛋白自身的基因长度就超过 了细菌的整个基因组大小(几千到上万个DNA 碱基)。而小小细菌,用一段几十个DNA 碱基 的CRISPR 序列,就把基因组定位的功能解决了。CRISPR,堪称超轻量级的基因组GPS。
而这一次人们对CRISPR 的研究恰逢其时。别忘了,二十一世纪初正是几种基因组编辑技术 方兴未艾,传统的基因治疗技术捷报频传的时候。CRISPR 理所当然地吸引了孜孜以求高效 编辑基因组技术的科学家的注意。
2005 年,就在那群好记性的西班牙科学家在许多细菌中发现了CRISPR 序列的时候,美国加 州大学伯克利分校的结构生物学家詹妮弗·杜德纳(Jennifer Doudna)偶然从地球微生物 学系的同事吉莉安·班服尓德(Jillian Banfield)那里听说了CRISPR。某天在校内的“言 论自由运动”咖啡馆小坐闲聊时,班服尓德告诉杜德纳,她的实验室从附近的铁矿中发现的 许多细菌,也带有这种神奇的CRISPR 序列。
加州大学伯克利分校(University of California, Berkeley)著名的“言论自由运动”咖 啡馆。加州大学伯克利分校素来是美国校园政治运动的急先锋,在上世纪六十年代的“言论 自由运动”(Free Speech Movement)更是成为美国民权运动的标志之一。
与一心想着解决细菌免疫问题的细菌学家们不同,杜德纳是早已功成名就的结构生物学家, 长期利用X 射线衍射的方法了解蛋白质大分子的三维结构。她尤其对和RNA 分子相关的蛋白 质结构感兴趣。因此当几年后杜德纳意识到CRISPR RNA 能够指导与之相结合的蛋白复合体 发现病毒入侵者时,她意识到现在轮到自己上战场了。
杜德纳原本的目标其实顺理成章。她希望利用自己的看家本领,在单个原子的尺度上,看清 楚CRISPR RNA 究竟如何实现病毒基因组的精确定位。
杜德纳的目标并不令人意外地实现了。我们现在知道,细菌中的一个名叫Cas9 的蛋白,能 够在CRISPR 的指引下精确定位基因组,随后剪切破坏目标DNA 的重复片段。杜德纳和同事 们的工作,从原子水平完美解释了细菌免疫系统、特别是CRISPR 这个超轻量级基因组GPS 的工作原理。
CRISPR/Cas9 系统的工作原理。在这张显然是过度简化的卡通图里,Cas9 蛋白(带着滑轮和 剪刀的溜冰鞋)在CRISPR RNA(冰鞋后面绿色的线段)的指导下在基因组(蓝色的双螺旋) 上逡巡定位,一旦CRISPR 发现一致的序列,Cas9 蛋白就停下来挥动剪刀。
然而和我们故事更相关的,其实倒是杜德纳和同事们漫漫探索道路上的一个副产品。
跨越半个地球的联手
实际上,杜德纳的目标一开始并没有对准Cas9 这把基因组剪刀。严格说起来,在杜德纳对 CRISPR 序列产生兴趣的2005 年,细菌学家们尽管已经猜测出CRISPR RNA 能起到基因组GPS 的作用,但是对于CRISPR 究竟如何定位、定位之后又是如何切割病毒基因组其实还相当模 糊。人们大概知道,有一个庞大的蛋白复合体(名为Cascade)应该起到了剪刀的作用,但 是因为这个复合体实在太大了,即便是杜德纳这样的结构生物学老手,一直也没有能把它的 精细结构看得很清楚。
直到2011 年。
三月初,杜德纳飞往美丽的加勒比海岛国波多黎各参加一场由美国微生物学会组织的会议。 会议的主题是细菌中的RNA 分子,这正是杜德纳整个职业生涯一直关注的目标。从尚在浓雾 时雨的北加州飞往阳光明媚的加勒比海,杜德纳的心情无疑是轻松愉快的。
直到有一位表情严肃的女科学家走上前来,轻声问道:“能出去走走,顺便请教您几个问题 么?”
这个女科学家是任教于瑞典于默奥大学的法国人埃马纽埃尔·卡彭蒂耶(Emmanuelle Charpentier)。这场不期而遇的对话标志着人类基因治疗领域新的起点,将毫无异议地被 写入当代科学史。

盛装亮相的两位女科学家。2014 年11 月,杜德纳(左)和卡彭蒂耶(右)一同获得了由硅 谷创业精英(包括脸书创始人Mark Zuckerberg,谷歌联合创始人Sergey Brin 等人)设立 的生命科学突破奖(Breakthrough Prize in Life Scienc-es),并获得了每人300 万美元 的奖金,这也是史上数额最大的科学奖项。
和杜德纳一样,卡彭蒂耶也对CRIPSR 序列有着特别的兴趣。而两人的研究背景却又大相径 庭,和结构生物学出身的杜德纳不同,卡彭蒂耶受过长期的细菌生物学训练,对细菌本身的 生物学更加熟悉。
而在这场对话中,卡彭蒂耶提到她自己的实验室在研究一种危险的人类致病菌——化脓链球 菌(Streptococcus pyogenes)——当中的CRISPR 序列。她的实验室发现在这种细菌中, 一种名叫Cas9(当时的名字是csn1)的蛋白,似乎就有独立完成利用CRISPR 序列定位和切 割病毒基因组的能力。这一点出乎杜德纳(也包括领域中大多数科学家)当时的预料。因为 按照当时的理解,人们一般认为识别和切割病毒基因组需要一大堆蛋白质的参与。
于是杜德纳和卡彭蒂耶水到渠成地开始了她们的合作:对杜德纳而言,研究一个蛋白质的结 构和功能显然比研究一大堆蛋白质轻松得多;而对于卡彭蒂耶而言,她也非常想从结构生物 学的角度,更好地理解Cas9 到底如何发挥功能的。
两个相隔万里之遥的实验室迅速地联起手来,她们的合作,最终在2014 年完美解释了 CRISPR/Cas9 系统的工作原理:Cas9 蛋白就像一个有着两块卡槽的接线板,能够同时插进一 条CRISPR RNA 和一条病毒基因组DNA,而当CRISPR RNA 和病毒DNA 的序列一一对应时,Cas9蛋白会发生变形,准确的卡住病毒DNA 并毫不犹豫的挥起剪刀。这正是细菌免疫系统的工作 原理。
一个充满惊喜的副产品在她们二人的合作中呱呱坠地。
2012 年夏天,两个实验室联手证明,的确如卡彭蒂耶所猜想,体外纯化的Cas9 蛋白单独就 可以发挥定位和切割基因组DNA 的功能(值得一提的是,立陶宛科学家Virginijus Siksnys 几乎在同一时间也做出了类似的发现)。更重要的是,她们发现,Cas9 蛋白定位的功能完 全依赖于CRISPR RNA 那么几十个碱基的序列信息,如果人工编辑CRISPR RNA,就可以让Cas9 蛋白指哪打哪,切割任意指定的DNA。这个结果清晰地指向了一种全新的基因组编辑技术: 理论上人们只需要设计一段几十个碱基的CRISPR,然后加上天然存在的Cas9 蛋白,就可以 随心所欲的定位和修改任何一段人类基因组了!
这时候,距离基于TALEN 蛋白的上一代的基因组编辑技术问世也不过短短一年。当科学家们 还在努力地学习TALEN 蛋白的组装方法,生物技术公司们还在跃跃欲试地准备用TALEN 蛋白 展开基因治疗的时候,CRISPR/Cas9 技术从天而降,宣示了TALEN 技术的终结:毕竟这一次, 要定位任意一段人类基因组序列,只需要科学家设计几十个碱基长度的序列即可,把基因组 编辑的工作量一下子降低了上千倍!
新技术走入现实,所有权大战揭幕
杜德纳和卡彭蒂耶的发现,不仅仅是一项可以帮助科学家定位和编辑基因组的基础研究手 段,尽管这项技术几乎肯定会获得诺贝尔奖。如果这项技术确实如两位女科学家所言那么高 效和便捷,也许整个基因治疗市场会被重新定义。谁能抢得先机,谁也许就能在这个广阔的 舞台和市场上占据先发优势。
在2013 年初短短数周时间内,三个研究组相继证明,人工设计的CRISPR 序列与Cas9 蛋白 结合,在人类细胞中同样可以高效地定位、剪切和修改基因组。这项人类基因组编辑的新技 术正式走入现实。这三个研究组包括杜德纳和卡彭蒂耶,也包括在TALEN 蛋白技术的开发者、 任教于哈佛大学医学院的乔治·切奇(George Church)和任教于麻省理工学院博德研究所 的张锋。
34 岁的张锋身后,已经有三项里程碑式的工作足以载入史册:光遗传学、TALEN 技术编辑基 因组、以及CRISPR 基因组编辑技术。张锋以青年研究员的身份在基因组技术先驱乔治·切 奇(George Church)实验室开始了TALEN 技术的开发,后在博德研究所首次使用CRISPR/Cas9 系统对哺乳动物细胞进行基因编辑(图片来自http://www.broadinstitute.org)
与以往的基因组编辑技术、例如锌手指蛋白技术和TALEN 蛋白技术相比,CRISPR 的优势实 在是太过明显。一方面,从工具准备的角度看,设计和生产一个用于定位的CRISPR,对于 任何一个稍经训练的生物学研究人员来说都是易如反掌的事情,远远简便于锌手指蛋白和 TALEN 蛋白的组装;另一方面,上述三个实验室的工作也证明,CRISPR 系统工作的效率要远 远高于其他两种技术,这意味着现实中改变任何生物乃至人类自身的基因组的成功率要高得 多。
甚至在张锋实验室的论文中,他们还证明可以一次性利用几个CRISPR 来实现对基因组的多 点精确打击,这是之前任何基因组编辑技术都无法达到的高效率。而在各种各样的工业应用 中,高效率就意味着低成本,意味着短周期,意味着把许多不可能变为可能。
因此几乎在第一时间,资本疯狂涌入了这个看起来遍地黄金的市场。是啊,在如此高效的技 术背景下,有太多太多愿景可以去自由畅想。我们是不是可以改造各种工业微生物,让酸奶 更可口,奶酪更香醇,葡萄酒更醉人?而我们,是不是也可以用它来修改受精卵的基因组、 以避免先天遗传病?甚至让我们人类更聪明,更健康,更长寿?
有市场分析认为,几年之内以CRISPR 为基础的基因组编辑市场会达到每年数十亿美元的市 场规模。而更乐观的估计则认为,这是一个年销售额接近500 亿美元的庞大市场。要知道, 当市场分析家做出这些预测时,CRISPR 技术刚刚有了还远不算成熟的原型,连实验室应用 都谈不上!
于是在全世界的实验室你追我赶继续完善和发展CRISPR 技术的同时,围绕着知识产权的战 争开始了。这并不奇怪,我们在前面的故事里已经讲过专利的重要性。面对CRISPR/Cas9 这项具有巨大潜在经济利益的技术,谁拥有了它的知识产权,谁就有可能最大化市场收益。
2014 年4 月15 日,美国专利与商标局(USPTO/US Patent and Trademark Of-fice)在万 众注目中,将与CRISPR/Cas9 技术相关的第一个专利,授予张锋所在的博德研究所,而张锋 是专利的第一发明人。这项内涵极其深广的专利涵盖了CRISPR/Cas9 技术在所有真核生物 ——包括各种动物、农作物和人类自身——中的应用。
CRISPR/Cas9 技术的第一项专利许可,授予博德研究所和麻省理工学院,发明人张锋,授予 日期2014 年4 月15 日,专利编号US 8,687,359。
这项专利意味着,从此以后,任何公司如果试图利用CRISPR/Cas9 技术改造动物、植物、微 生物乃至人类自己,必须首先从博德研究所获得专利授权,否则就侵犯了博德研究所的专利 权。博德研究所靠这项专利不光可以坐拥主动送上门来的滚滚专利许可费,而且可以从源头 控制整个基因编辑和基因治疗产业!
这边博德研究所的庆功酒还没开场,那边的枪炮番茄已经一齐丢了过来。围绕CRISPR/Cas9 技术的所有权问题,一场战争一触即发。
CRISPR 到底是谁的?
等一等,这里面是不是有几个问题?从我们的故事来看,CRISPR/Cas9 技术最早的发现者难 道不是杜德纳和卡彭蒂耶?为什么她们没有拿到专利?就算是张锋实验室确实最早证明这 项技术在真核生物细胞中可以工作,那差不多同时哈佛大学的切奇实验室、以及杜德纳本人 也证明了这一点,为什么专利不是三方共享?而且,就算专利局认为张锋的发现最为关键, 那专利的持有人为什么不是张锋自己,而是张锋所工作的博德研究所?
这些问题听起来简单,想几句话交代清楚还真不容易。
先说简单的。雇员在工作中做出的成果,也就是所谓的“职务发明”,成果归属雇员还是雇 主一般而言是个国家专利法的管辖范围。世界上大多数国家的专利法(也包括美国)都遵循 “雇主优先”的原则,即知识产权归属雇主。事实上即便是非“雇主优先”系统的国家,雇 主们一般也会在员工合同中就职务发明做出规定,例如强制雇员将发明所有权让渡给雇主这 样的条款。
因此,在绝大多数情况下,雇主自然地是雇员工作产生的知识产权的拥有者,这一点对于工 作性质更多是自由探索的科学家来说也不例外。因此,张锋所在的博德研究所自然成为了这 项专利的所有者。事实上,博德研究所的大股东,哈佛大学和麻省理工学院也自然地成为了 这项专利的所有者,只是这两家不参与专利的日常管理而已。
那么为什么这样一个万众瞩目的专利花落博德研究所,而没有杜德纳和卡彭蒂耶她们什么事呢?
实际上,杜德纳和卡彭蒂耶所在的加州大学和维也纳大学也绝不会无视CRISPR/Cas9 技术的 巨大潜在利益,它们早在两位科学家的学术论文发表前,就已经在2012 年6 月份向美国专 利与商标局提交了正式的专利申请。
要知道,张锋和博德研究所的专利申请实际上要晚得多:要到2012 年底,张锋实验室证明 CRISPR/Cas9 技术能够应用于人类细胞基因组编辑的时候,才正式提交!虽说博德研究所的 专利律师成功地走了条快速审查的绿色通道,缴纳费用让专利局先审查自己的专利,但是也 不该这样就后来居上了呀?难道是专利局的人黑吃黑?
黑吃黑是没有的,但是这个问题说来就复杂了。
在世界上绝大多数国家的专利法系统里,如果出现不同人或实体试图申请同一类东西的专利 的时候,一般遵循谁先申请谁能获得专利的排队规则(“first-to-file”),这样相对来 说纠纷比较少,因为谁先递交的申请有据可查一目了然,也相对来说能够刺激发明人尽快申 请专利。而美国长久以来采用所谓谁先发明谁能获得专利的排队规则 (“first-to-invent”),而且在长达十几年的时间里是全世界唯一一个还实行这种规则 的国家。
这种谁先发明谁获得专利的系统,看起来初衷当然是很理想主义的:专利应该保护真正率先 将它实现的人,而不是那个急匆匆提交专利申请的人。但是这个系统在现实操作中却会遇到一个绕不过去的问题:专利申请人如何证明自己才是那个第一个发明的人?总不能靠自己红 口白牙去说吧?可能也是基于这个理由,美国决定在2013 年前后将专利法系统整个改革, 追随一下“世界潮流”,也开始按照谁先申请谁获得专利的办法做事了。
可是别忘了,不管是杜德纳/卡彭蒂耶身后的加州大学系统,还是张锋身后的博德研究所, 都是在2012 年提交的专利申请,因此,专利局对他们两方专利权的认定,还是必须按照那 个比较天真幼稚的“谁先发明谁获得专利”来。换句话说,想要打赢这场可能价值百亿美元 的专利大战,双方必须提供充足的证据,证明自己一方率先发明了这项技术!
2011 年9 月16 日,美国总统奥巴马签署批准美国发明法案,正式确定了美国专利法系统将 于2013 年3 月16 日转向谁先申请谁获得专利的“first-to-file”系统。不要小看了专利 法范畴的这么个小小变化。对知识产权的保护是美国的立国精神之一。美国的立国之本、1787 年美国宪法中,已经明文规定,为了保障科学和技术的进步,国会有权利授予作家和发明家 著作权和专利权的保障。
就这一点而言杜德纳和卡彭蒂耶本来是有天然的优势的,毕竟她们俩在2012 年中率先发表 论文证明了CRISPR/Cas9 技术的可行性,而张锋实验室的论文要到2013 年1 月才问世。
然而有备而来的博德研究所一口气提交了上千页的原始证据,从基金申请书、个人通信记录 一直到实验记录本,试图证明张锋实验室早在2012 年初、杜德纳/卡彭蒂耶的论文发表前已 经独立发明了这项技术。
与此同时,博德研究所的另一项有力指控是,尽管杜德纳/卡彭蒂耶的论文说明CRISPR/Cas9 技术的可行性,但是张锋实验室却是首先证明这项技术能够应用于改造细胞内基因组的,因 此如果想要在动物、植物甚至人类的细胞中编辑基因组,理所应当从博德研究所获得授权。
听起来似乎说理充分、论据十足,可能这项专利花落博德研究所是顺理成章了?
先别急,深感被忽悠和羞辱了的杜德纳/卡彭蒂耶一方显然不会那么容易放弃这只下金蛋的 鹅。在一年的精心准备之后,加州大学于2015 年4 月向美国专利与商标局提交了多达114 页的抗辩材料,以及几千页的补充证据。他们试图让美国专利局相信,博德研究所的专利无 效,而加州大学才是这项技术真正的拥有者!
加州大学提交的证据似乎也滴水不漏,一方面,他们试图说明,张锋实验室所提交的参考材 料——包括实验记录本——仅仅能说明对方进行了相关的尝试,并未说明这些尝试真的成功 了。其次,针对博德研究所所谓“率先在细胞内应用CRISPR/Cas9 技术”的声明,加州大学 的立场是,从杜德纳/卡彭蒂耶的论文中猜测和联想到这项技术能够用于细胞内是显而易见、 顺水推舟的事情,根本不足以支持一项发明专利的创新性。
针尖对麦芒,三个CRISPR 领域世界顶尖的实验室,两家在生物医学领域引领时代的研究机 构,就这么宣战了。事实上,加州大学的抗辩宣告了关于CRISPR 所有权的争议几乎已经不 存在任何和解的可能,如果专利局判定加州大学的抗辩有效,那么博德研究所就将失去围绕 CRISPR 的一切知识产权;反过来如果专利局裁定加州大学抗辩无效,那么杜德纳他们只能 两手空空地看着博德研究所从此独占基因组编辑和基因治疗这个巨大市场。
2016 年1 月11 日,美国专利与商标局宣布启动抵触审查程序(Interference proceeding), 重新审核CRISPR/Cas9 技术的专利。这意味着,专利申请双方——麻省理工学院和加州大学 将正面对决,出示能够证明自己最先发明CRISPR/Cas9 技术的相关证据。
现在,整个世界,都在屏息等待着美国专利局的裁决。上一次以一纸薄薄的专利授权书吸引 全世界的目光,可能要追溯到近一百年前,天才的勤杂工、发明家费罗·法恩斯沃斯(Philo Farnsworth)赢得了与巨无霸美国广播公司(Radio Corporation of America, RCA)的专 利权官司,捍卫了自己是电视发明人的地位!
费罗·法恩斯沃斯,“电视之父”,美国的国家英雄。对于中国的读者来说,电视发明人的 称号往往和另一位发明家、英国的贝尔(John L Baird)联系在一起。实际上,贝尔确实是 世界上第一台电视的发明人,但是日后使用更加广泛的阴极射线管电视(也就是我们耳熟能 详的显像管电视)则出自法恩斯沃斯之手。法恩斯沃斯虽然成功捍卫了自己的电视发明专利 和“电视之父”的称号,但是本人却没有从电视的商业化中获利。
基因治疗,下一个光荣和梦想
专利所有权之争,似乎并没有阻挡资本的脚步。
尽管现在谁都难以预测CRISPR 技术的专利终将花落谁家,又或者是否能以一种共赢的方式 达成和解,投资人和医疗行业巨头们对这项技术的兴趣还在不断高涨。
人们利用不同的基因组改造技术试图征服遗传疾病的尝试,有辉煌的成功,也有惨痛的失败。 但是大体而言,基因治疗领域始终在紧跟基础研究的步伐。
在上世纪九十年代,人们已经开始利用病毒载体,把DNA 以一种“缺啥补啥”的逻辑补充到 基因缺陷疾病患者的体内。等到更精细的基因组编辑技术——包括锌手指蛋白和TALEN 蛋白 ——出现,人们开始看到希望,这些对基因组进行精确定位和编辑的技术,也许能够极大地 完善基因疗法的技术手段。毕竟,传统基因疗法仅仅是把出现缺陷的DNA 重新放回患者体内, 至于放回的效率、数量和地点都难以控制。如果说新兴的基因组编辑技术像是高精度的巡航 导弹,传统的基因疗法可能最多算是大炮炮弹,有杀伤力,但是太粗放、太低效、太有破坏 性。
CRISPR/Cas9 技术的登场,把基因治疗的武器库升级到一种前所未有的高度:它的设计和制 造极其简单,技术门槛很低(只需要设计一段几十个碱基构成的CRISPR 序列);它的打击 效率非常高,甚至可以实现一次发射、多重打击(可以一次基因治疗使用多个CRISPR 片段, 同时修改几个疾病位点);它的打击方式更加多样化(人们已经证明,使用CRISPR、Cas9 技术,可以对特定基因组位点实现删除、修复、替换等等功能)。
因此尽管专利权之争尚未尘埃落定,针对CRISPR 技术的研究和临床应用已经蓬蓬勃勃地开展起来。
CRISPR/Cas9 技术商业化的“四国大战”。四家公司的核心技术平台和发展方向可能极为接 近,在未来他们将会发展出不同的疾病方向,亦或是将会联手攻克某种疾病,让我们拭目以 待!
而这次的竞争,大概要比专利权之争更为复杂。加州大学的杜德纳参与成立了Caribou Biosciences 和Intella Therapeutics 两家公司,并且从她所工作的加州大学那里获得了 CRISPR 专利的独家授权(是的,即便是尚未获得批准的专利也可以授权)。
其中Intella 的主攻方向即是利用CRISPR/Cas9 技术进行人体基因治疗。杜德纳的合作伙伴 卡彭蒂耶参与成立了总部位于瑞士巴塞尔的CRISPR Therapeutics 公司;而杜德纳的直接竞 争者、哈佛的切奇与博德的张锋则联手创立的Editas Medicine 公司(杜德纳也参与了该公 司的创立,但自张锋申请专利之后,Doudna 断绝了与Editas 的关系),在2016 年1 月4 日(没错,上个月初)向美国证券交易委员会(SEC)提交招股说明书,准备在纳斯达克上 市(证券代码为“EDIT”)。
毫无疑问,利用CRISPR/Cas9 技术进行人体基因治疗将是重中之重。有Sangamo 的教训在先, 我倒是很开心看到这样的竞争。要知道,这些天才头脑之间的竞争和碰撞,带给我们的惊喜, 也许会远远超过我们哪怕是最狂热的想象。
而我们对自身遗传信息的编辑和修改,会不会是人类走向亿万光年之外和原子之间这漫漫征 途上,下一个光荣与梦想?毕竟,这也许是造物以来,有机生命第一次有能力有意识地改造 自己!


